Tout sur les détecteurs de gaz
Découvrez tout ce qu’il faut savoir sur les appareils de mesure de gaz et leur fonctionnement.
Pourquoi a-t-on besoin de détecteurs de gaz ?
Au cours de l’évolution, l’homme s’est adapté à l’atmosphère terrestre. L’organisme humain fonctionne de manière optimale dans 21 % d’oxygène et 79 % d’azote. Les gaz traces ubiquitaires commele CO2 et les gaz rares sont négligés. De petites variations dans la composition affectent le bien-être, de plus grandes affectent la santé et de très grandes peuvent être mortelles. Même en très faibles concentrations, les gaz toxiques peuvent être extrêmement nocifs pour la santé. On distingue les dangers suivants :
- Manque d’oxygène
- Présence de gaz explosifs
- Présence de gaz toxiques
Les déviations susmentionnées peuvent aussi bien se produire dans la nature qu’être causées par l’homme. Dans notre société industrielle, c’est cette dernière qui prédomine. Les processus de décomposition, qui produisent à la fois des gaz combustibles (méthane) et des gaz toxiques (sulfure d’hydrogène, dioxyde de carbone, mercaptans et bien d’autres), sont des exemples typiques d’écarts naturels. Ces gaz s’accumulent volontiers dans les fosses ou les dépressions. Un accident typique est celui dit de la fosse à purin : quelqu’un s’approche trop près d’une fosse à purin, inhale du sulfure d’hydrogène, qui provoque une paralysie respiratoire. L’accidenté tombe dans la fosse et se noie ou s’asphyxie. Les personnes qui tentent de lui venir en aide subissent le même sort.
Pourtant, il n’est pas courant d’avoir des détecteurs de gaz dans les exploitations agricoles. Il en va tout autrement dans les entreprises de traitement des eaux usées. Des processus de fermentation similaires ont lieu dans leurs bassins. L’arrivée au niveau des dégrilleurs est déjà surveillée à l’aide d’une technique de mesure stationnaire pour détecter la présence de gaz inflammables. Les eaux usées qui arrivent pourraient en effet déjà émettre du méthane ou transporter des carburants ou des solvants. Dans les zones de travail, les employés sont équipés d’appareils qui peuvent même détecter plusieurs gaz. Typiquement, ils mesurent les gaz inflammables, le manque d’oxygène, le dioxyde de carbone et le sulfure d’hydrogène.
1. Une excursion dans l’histoire
On sait depuis l’Antiquité que la fermentation alcoolique produit des gaz dangereux. Depuis des temps immémoriaux, les viticulteurs placent une bougie au fond de leur cave de fermentation, et si elle s’éteint par manque d’oxygène, ils doivent quitter la cave. Bien sûr, ils ne pouvaient pas savoir autrefois que le danger venait du dioxyde de carbone. Ils ne savaient pas non plus que le dioxyde de carbone est toxique à partir de 0,5 %, mais que la bougie ne s’éteint qu’à environ 10 %.
Un autre exemple typique de gaz d’origine naturelle est l’exploitation minière. Ce que l’on appelle le « temps qui bat » contient du monoxyde de carbone toxique et du méthane explosif. Il n’est donc pas étonnant que ce soit dans l’industrie minière que l’on ait tenté très tôt de détecter à temps le danger représenté par le gaz. Peu après la naissance du Christ, on connaissait déjà les risques pour la santé liés à l’extraction du mercure, par exemple. Un écrit de Pline l’Ancien, datant d’environ 100 après J.-C., en fait état. On essayait en vain de se protéger avec des masques en fougère.
Les auteurs ultérieurs (1556 Georgius Agricola : « De Re Metallica », vers 1700 et Bernardino Ramazzini : « De Morbis Artificium Diatribe ») connaissaient également les dangers du gaz dans l’industrie minière. Il n’existe toutefois pas de moyen de détecter le gaz. Comme on ne savait pas encore à l’époque ce qu’était un gaz, cela aurait été difficile. On peut donc en conclure qu’il n’existait aucun moyen de déterminer si l’atmosphère était dangereuse.
Lorsque la révolution industrielle a exigé l’extraction de toujours plus de charbon, le besoin de mesurer les gaz dangereux s’est fait sentir. Il faut dire qu’on ne savait pas quelles substances étaient à l’origine du danger, mais on connaissait la présence d’un danger diffus.
Pour éliminer les gaz éventuellement dangereux, on a envoyé des spécialistes, appelés « pompiers », devant. Le méthane inflammable est spécifiquement plus léger que l’air et s’accumule donc sous le plafond. Les pompiers plaçaient une bougie juste sous le plafond pour qu’elle enflamme le méthane. Cette méthode était loin d’être inoffensive. Si une atmosphère explosive s’était formée à la place du méthane fortement enrichi, les conséquences pouvaient être fatales. Pompier était un métier très dangereux.

Vers le milieu du 18e siècle, on a remarqué que des substances dangereuses modifiaient l’apparence de la flamme d’une bougie. Pour rendre la bougie inoffensive en tant que source d’allumage, on a essayé de séparer la flamme de l’atmosphère par des colonnes d’eau. Mais cette méthode était très compliquée. Finalement, l’idée de Humphrey Davy de séparer la flamme de l’atmosphère par des filets métalliques à mailles serrées s’est imposée. En 1816, les premières lampes Davy ont été testées en Angleterre. Il s’agissait de lampes à huile dont la flamme brûlait derrière un type primitif de pare-flamme.
Pendant plus de 150 ans, la lampe Davy originale, avec quelques améliorations au fil du temps, sera le seul moyen de détection des gaz. Il y a eu des tentatives pour faciliter l’estimation de la hauteur de la flamme en installant une échelle graduée. L’installation d’un capteur bimétallique pourrait déjà être considérée comme le précurseur d’une mesure de la température de la flamme. (Plus il y avait de méthane, plus il y avait de combustible disponible, plus la flamme était chaude, plus la déviation du bimétal était importante).
Certes, on disposait désormais d’un outil permettant de produire de la lumière et, avec un peu d’expérience, d’évaluer la présence de gaz dangereux. Mais cette méthode nécessitait que l’air ambiant contienne suffisamment d’oxygène. Malheureusement, ce n’est pas du tout sûr sous terre. Dieu merci, les méthodes de détection de gaz se sont depuis lors de plus en plus affinées.
Retour à l’époque actuelle, donc.
2. Comment fonctionnent les détecteurs de gaz modernes ?
2.1 Mesure des gaz combustibles
2.1.1 Capteurs catalytiques
Ces capteurs utilisent la propriété des matières combustibles à dégager de l’énergie lors de leur combustion. C’est pourquoi on les appelle aussi capteurs de chaleur. Voici ce qui se passe lors de la combustion du méthane, par exemple :
CH4 + 2 O2 -> CO2 + 2 H2O + Énergie
L’énergie dégagée par cette réaction est d’autant plus importante que la quantité de méthane dans l’air est élevée. Il ne restait plus qu’à imaginer un dispositif permettant de déterminer avec précision l’énergie dégagée. Pour cela, on utilise deux perles de céramique (également appelées pellistors), toutes deux chauffées à environ 400 °C par un filament de platine à l’intérieur. L’un des filaments est recouvert d’un revêtement catalytique. Le méthane est oxydé à sa surface, c’est-à-dire que de l’énergie est libérée et que le filament continue à se réchauffer. Cet échauffement augmente la résistance électrique du filament. Le deuxième filament n’est pas recouvert d’un revêtement catalytique, aucune oxydation ne se produit sur lui. En comparant avec cet élément passif, on compense le signal contre les variations de température extérieures, le flux d’air, l’humidité, etc. car ces influences agissent de la même manière sur les deux perles de céramique.
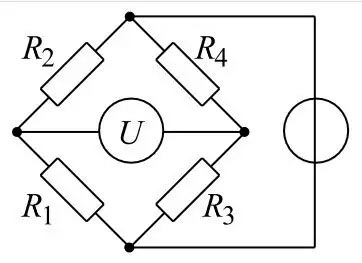
Une méthode très précise pour mesurer les variations de résistance est le pont de Wheatstone.
Les deux hélices sont connectées comme les branches d’un pont de Wheatstone. Cette méthode permet de mesurer très précisément la variation de résistance, et donc indirectement la teneur en combustible de l’atmosphère. Ce signal peut être utilisé pour évaluer si l’atmosphère est explosive ou non. On ne veut pas connaître la concentration réelle. On veut seulement savoir s’il y a un risque d’explosion ou non. C’est pourquoi on règle la plage de mesure sur 0 – 100 % LIE (= limite inférieure d’explosivité). Malheureusement, la LIE est une grandeur spécifique à la substance. Il faut donc savoir à quel gaz on a affaire. Ensuite, il faut chercher dans la littérature à quelle concentration de ce gaz correspond la LIE.
Les choses se compliquent lorsque des mélanges de gaz peuvent apparaître. Comme on ne peut généralement pas prévoir la composition proportionnelle, on s’aide d’un étalonnage dit de sécurité. Dans ce cas, on ne règle pas du tout son appareil de mesure sur le mélange de gaz attendu, mais sur une substance qui est détectée avec une sensibilité moindre. Le nonane est souvent utilisé, car il possède une LIE très faible. Comme le nonane est un liquide, un étalonnage au nonane sur le terrain serait toutefois très compliqué. Il est difficile, et donc sujet à de grandes erreurs, de produire sur le terrain un mélange gazeux précis à partir d’un liquide.
C’est pourquoi Compur Monitors propose un « double étalonnage ». L’étalonnage est effectué en laboratoire avec du nonane, puis une deuxième fois avec un gaz de référence, par exemple du butane. Le facteur de référence est inscrit sur le capteur, ce qui permet à l’utilisateur de calibrer facilement sur le terrain avec un mélange air/butane provenant d’une bouteille du commerce. Il applique ensuite le facteur de référence à cette bouteille.
Les capteurs catalytiques présentent de nombreux avantages :
Bien sûr, il y a aussi des inconvénients :
2.1.2 Capteurs infrarouges
De nombreux gaz absorbent la lumière à une longueur d’onde bien précise. Chaque molécule prélève un certain nombre de quanta de lumière dans un rayon lumineux. Cette énergie est utilisée pour faire vibrer certains électrons de la molécule. Heureusement, cet effet ne se produit qu’à des longueurs d’onde bien précises. En choisissant correctement la longueur d’onde, on peut donc déterminer quel gaz l’appareil doit mesurer. Pour mesurer les hydrocarbures, on choisit 3,4 μ. À cette longueur d’onde, la liaison C – H des hydrocarbures absorbe. Si l’on peut donc mesurer la quantité d’énergie absorbée, on peut en déduire la quantité de molécules de gaz sur le trajet de la lumière.
Un détecteur de gaz à infrarouge est donc conçu de la manière suivante : On envoie un faisceau lumineux à travers une cuvette à l’extrémité de laquelle se trouve un détecteur de lumière.
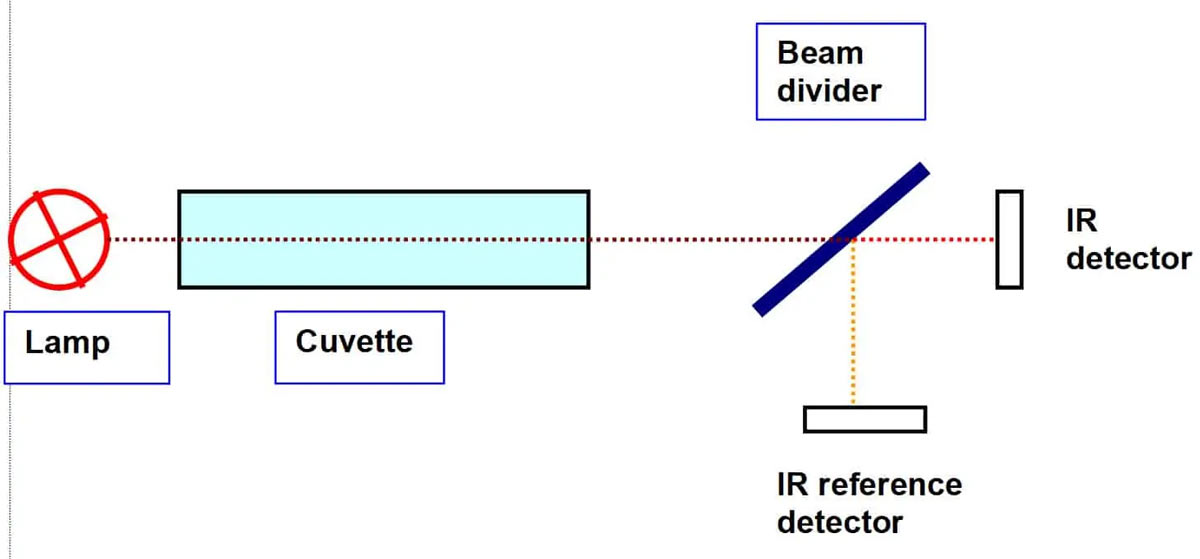
Moins le détecteur reçoit de lumière, plus il y a de gaz dans la cuvette. Pour compenser d’autres influences environnementales comme l’humidité, la pression ou la température, on utilise un deuxième faisceau avec une autre longueur d’onde. Pour produire une lumière d’une longueur d’onde bien précise, on utilise des filtres, des réseaux optiques, des prismes ou même des sources lumineuses LED d’une certaine couleur.
On peut tout aussi bien diviser un seul faisceau lumineux derrière la cuvette en deux faisceaux de longueurs d’onde différentes.
Les capteurs infrarouges présentent plusieurs avantages :
Bien sûr, il y a aussi des inconvénients :
2.1.3 Capteurs de température de flamme
Comme décrit précédemment pour la lampe de Davy, la présence d’un gaz combustible augmente la température d’une flamme. On utilise généralement une flamme d’hydrogène. Un capteur de température précis placé dans la flamme permet de détecter facilement l’augmentation de la température générée par le gaz.
Les capteurs de température de flamme présentent plusieurs avantages :
Bien sûr, il y a aussi des inconvénients :
3. Mesure des gaz toxiques
3.1 Capteurs électrochimiques
On peut imaginer les capteurs électrochimiques comme une batterie alimentée par du gaz. Tant qu’il n’y a pas de gaz, il ne se passe rien. Dès qu’un gaz donné entre en contact avec l’électrode de travail, une réaction se produit, au cours de laquelle des électrons sont produits ou consommés. Ceux-ci circulent vers la contre-électrode via un appareil de mesure très sensible.
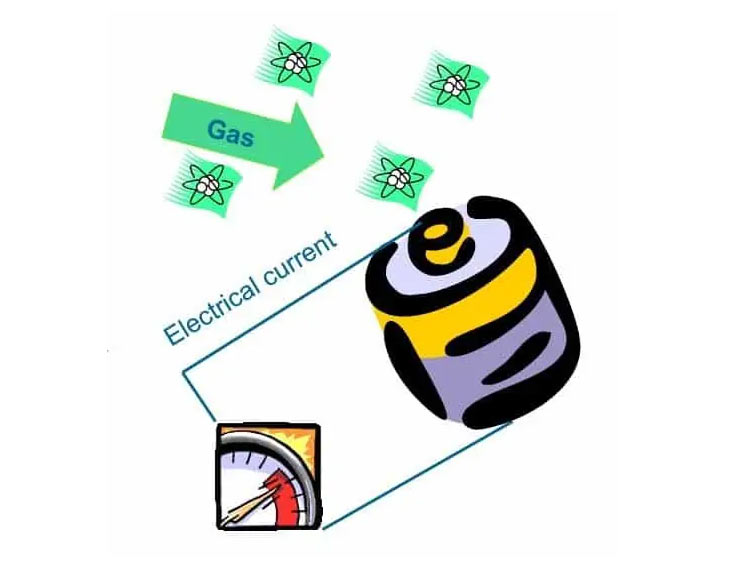
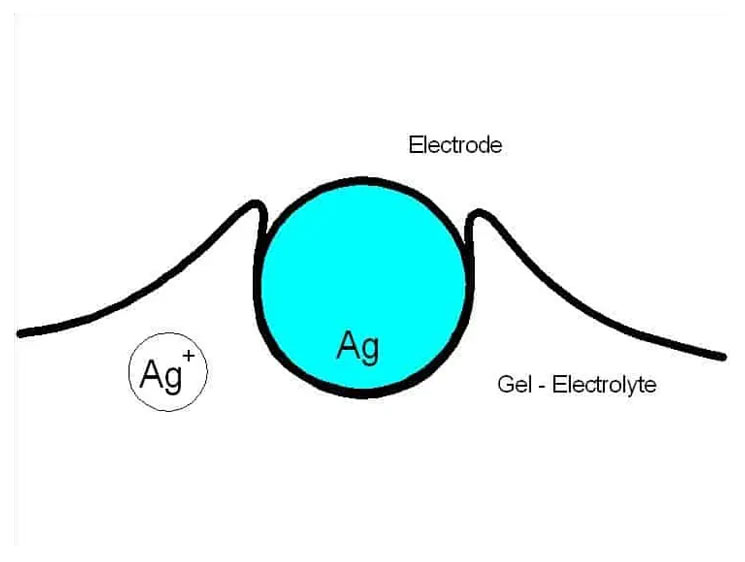
Que se passe-t-il exactement ?
Dans l’air, l’argent s’oxyde. On connaît ce phénomène dans le ménage : les couverts en argent noircissent au contact de l’air. D’un point de vue chimique, il se forme de l’oxyde d’argent. Celui-ci se présente sous forme d’ions :
2 Ag0 -> 2 Ag+ + 4 e–
Ce processus se poursuit jusqu’à ce qu’un équilibre entre l’argent élémentaire et les ions d’argent soit atteint. Un gaz est alors ajouté, qui réagit avec les ions d’argent : H2S + 2 Ag+ -> Ag2S↓ + 2 H+
Le sulfure d’argent est insoluble. Des ions sont ainsi retirés de l’équilibre. L’électrode de travail est obligée de produire de nouveaux ions, et donc des électrons, qui circulent à travers l’appareil de mesure vers la contre-électrode. Un courant de quelques nA circule.
Comme chaque molécule de gaz génère un nombre d’électrons bien précis, le courant est proportionnel au nombre de molécules de gaz qu’elle rencontre. Il est maintenant facile de prédire ce que le capteur décrit ci-dessus peut mesurer : Tous les gaz qui forment un sel insoluble avec l’argent. En fait, cette technologie de capteur est utilisée pour mesurer le H2S, le HCl, le HCN et le COCl2. Cette méthode de mesure est donc très spécifique. Elle est en outre si sensible qu’elle permet de mesurer de manière fiable des gaz dont les valeurs limites sont très basses.
En choisissant les bons matériaux d’électrode et le bon électrolyte, il est possible de développer des capteurs ciblés qui détectent des substances très spécifiques. Malheureusement, toutes les substances ne sont pas suffisamment réactives pour réagir avec le gaz à mesurer sans énergie auxiliaire. C’est pourquoi les capteurs électrochimiques sont principalement utilisés pour mesurer les gaz toxiques inorganiques et l’oxygène.
Les capteurs électrochimiques présentent certains avantages :
Bien sûr, il y a aussi des inconvénients :
3.2 Capteurs PID
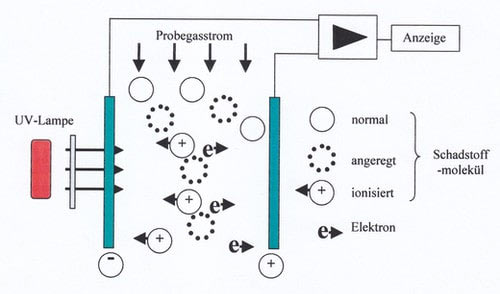
Les capteurs PID utilisent le fait que la lumière UV de très haute énergie décompose les molécules de gaz en radicaux. Ceux-ci sont chargés électriquement. On peut facilement compter les particules chargées en les faisant passer à travers une cuvette dont la paroi est chargée électriquement. Les particules chargées positivement sont attirées par l’électrode chargée négativement et inversement. Elles y compensent leur charge électrique. Le courant de décharge est proportionnel au nombre de molécules, c’est-à-dire à la concentration.
Les sources UV utilisées sont des lampes de 10,6 ou 11,7 eV. Cette énergie n’est pas suffisante pour ioniser les molécules d’eau, d’oxygène ou d’azote. Le PID ne réagit donc pas aux substances qui sont de toute façon présentes dans l’air. Or, ces substances sont très nombreuses, notamment les hydrocarbures. Malheureusement, elles sont toutes affichées avec des sensibilités différentes.
La plupart de ces substances sont des liquides. On essaie autant que possible d’éviter un étalonnage avec un liquide. On s’est donc mis d’accord pour toujours calibrer avec de l’isobutène et pour déterminer les facteurs de référence du plus grand nombre possible de substances par rapport à l’isobutène. Ainsi, on peut facilement calibrer avec un gaz. Ces facteurs sont disponibles dans la littérature, ou par exemple à télécharger ici.
Les capteurs PID présentent certains avantages :
Bien sûr, il y a aussi des inconvénients :
3.3 Capteurs de conductivité thermique
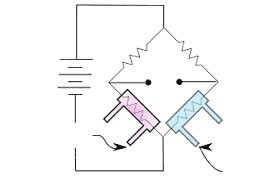
De nombreux gaz conduisent différemment la chaleur par rapport à l’air. On peut utiliser cet effet pour déterminer la concentration en mesurant la conductivité thermique de l’atmosphère.
Pour cela, on place une source de chaleur et un thermomètre dans une cellule traversée par un courant. Ici aussi, on utilise une cellule de référence pour compenser les influences de la température (bien sûr extrêmement importante ici), de l’humidité et de la pression.
Si l’échantillon dans la cellule de mesure contient un gaz qui conduit mieux ou moins bien la chaleur que l’air, le thermomètre de la cellule de mesure mesurera une autre valeur.
Les capteurs de conductivité thermique présentent plusieurs avantages :
Bien sûr, il y a aussi des inconvénients :

Dr. Josef von Stackelberg
Directeur général COMPUR MONITORS GmbH & Co. KG
Contactez-nous sans engagement
Vous avez des questions sur nos produits ou vous souhaitez un conseil sans engagement ? N’hésitez pas à nous contacter.